№ 362.
| Дано: |
C(графит)+ Со2 (г.) 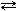 2СО(г.) sНо = 172,5 кДж 2СО(г.) sНо = 172,5 кДж |
| Найти: |
| а) Как изменится содержание СО в равновесной смеси с повышением температуры но при неизменном давлении? С ростом общего давления но при неизменной температуре?
б) Изменится ли константа равновесия при условии повышения общего давления и неизменной температуре? При условии увеличения температуры? При условии введения в систему катализатора? |
| Решение: |
| а) Из-за того, что sНо = 172,5 кДж > 0 – реакция экзотермическая, потому при условии повышения температуры, и при неизменном давлении, равновесие сместится влево, то есть в сторону обратной, соответственно концентрация СО в смеси уменьшится.
При неизменной температуре увеличение давления приведет к уменьшению объема системы, которая в свою очередь вызовет увеличение концентрации веществ, которые принимают участие в реакции. Если до увеличения давления скорость прямой реакции была: v1 = k1[CO2], а обратной: v2 = k2[CO]2 . Будем считать, что концентрации веществ увеличились у n раз, тогда скорости реакций: v1’ = k1n[CO2]= nv1 – прямая; v2’ = k2(n[CO])2 = n2v2 – обратная; => Скорость обратной реакции после повышения давления увеличится у n2 раз, а прямая лишь в n, значит концентрация СО в смеси уменьшится. б) На константу равновесия изменение давления при неизменной температуре не повлияет потому, что она зависит лишь от природы веществ, которые принимают участие в реакции и от температуры. Да. – К.Р. зависит от температуры. Нет. Потому что катализатор одинаково изменяет энергию активации как прямой, так и обратной реакции. Из-за этого он не влияет на отношение констант и скоростей реакций, потому катализатор не влияет на размер константы равновесия и, соответственно, не может ни увеличить, ни уменьшить выход реакции. Он лишь может пришвидшити или замедлить наступление равновесия. |