Растворы электролитов
Растворы солей проводят электрический ток вследствие диссоциации солей на катионы и анионы. Диссоциация становится возможной только благодаря взаимодействию ионов с дипольными молекулами воды.
Результат диссоциации - законы для разбавленных растворов неэлектролитов не работают - вследствие диссоциации увеличивается число частиц. Отсюда появляется изотонический коэффициент i.
P=iCRT, DТкип. = iЕm, DТзам. = iКm, и т.д.
Изотонический коэффициент связан со степенью диссоциации электролита a - отношение числа распавшихся на ионы молекул к общему числу молекул:

Это уравнение легко вывести, подсчитав увеличение числа частиц.
Электролиты делятся на: сильные a~1, средние a~30%, слабые a<0.1.
Сильные электролиты : соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, кальция, стронция и бария.
Остальные кислоты и основания - средние или слабые электролиты.
Рассмотрим равновесие в растворе слабого электролита.
KA « K+ + A- (на самом деле KA + aq « K+aq+ A-aq)
Концентрация раствора С моль/л.
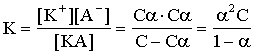
Для очень слабых электролитов a®0, получаем Кд = a2С - закон разбавления Оствальда. Почему разбавления? Потому, что Кд - константа диссоциации слабого электролита - величина постоянная при данной температуре, следовательно чем больше С, тем меньше a. Степень диссоциации слабого электролита растет с разбавлением.
Все вышеприведенные выкладки годятся только для слабых электролитов. Для сильных электролитов, где a близка к 1, константа диссоциации теряет смысл. Количество ионов очень велико и при достаточно большой концентрации может наблюдаться ассоциация ионов. Поэтому для сильных электролитов Льюис ввел понятие кажущейся степени диссоциации и о кажущейся концентрации ионов - активности.
a = gC, где а - активность, а g- коэффициент активности.
В разбавленных растворах а=С, т.е. g стремится к 1.
Диссоциация кислот, оснований и солей в воде.
Средние соли диссоциируют нацело: Na2SO4«2Na++ SO42-.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато:
H3PO4 « H+ + H2PO4- K1= 7.11×10-3
H2PO4- « H+ + HPO42- K2 = 6.34×10-8
HPO42- « H+ + PO43- K3 = 4.4×10-13
Очевидно, что константы диссоциации по различным степеням сильно отличаются друг от друга K1>>K2>>K3. Отсюда существование кислых и основных солей.
Все это мы пишем, не учитывая, что образуются гидратированные ионы. На самом деле происходит следующее:
Zn2+ в воде [Zn(H2O)4]2+, Zn(OH)2 на самом деле [Zn(OH)2(H2O)2] и его диссоциация как амфотерного электролита происходит следующим образом:
[Zn(OH)2(H2O)2] « [Zn(OH)3H2O]-+ H+ « [Zn(OH)4]2- + H+ или
[Zn(OH)2(H2O)2] « [ZnOH(H2O)3]+ + OH- « [Zn(H2O)4]2+ + OH-.
Именно поэтому в растворе мы не получаем Na2ZnO2, а получаем Na2[Zn(OH)4].
На степень диссоциации слабого электролита можно влиять
а) разбавлением, как было показано выше;
б) введением одноименных ионов.
HCN « H+ + CN-
если ввести в раствор CN- (NaCN), то по правилу Ле Шателье равновесие сместится влево и количество ионов водорода уменьшится.