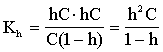Варианты гидролиза.
1) Соль образована сильным основанием и сильной кислотой - гидролизу не подвергается, рН = 7.
2)Соль образована катионом сильного основания и слабой кислотой - гидролиз по аниону.
CN-+ H2O « HCN + OH- pH>7
3) Соль образована слабым основанием и сильной кислотой - гидролиз по катиону.
Сu2++ H2O « CuOH+ + H+ pH<7
Обратить внимание, что пишем только первую стадию, присоединение одного гидроксила. Вторая стадия не идет, т.к. накопление протонов смещает равновесие влево.
4) Соль образована слабым основанием и слабой кислотой
Al(CH3COO)3
Al3+ + 3CH3COO- + 3H2O « Al(OH)3 + 3CH3COOH
Гидролиз по катиону и аниону одновременно идет до конца, ацетат алюминия в растворе не существует, выпадает осадок гидроокиси. рН »7 и определяется тем, что сильнее - кислота или основание.
Вопросы: в какой мере идет гидролиз, каким будет значение рН, какие факторы влияют на гидролиз?
Гидролиз - обратимый, равновесный процесс, следовательно для гидролиза, например, цианида калия можно записать:
CN-+ H2O « HCN + OH-
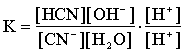
Домножив числитель и знаменатель на концентрацию протонов и введя постоянную концентрацию воды в константу, получим:
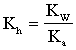
Чем слабее кислота (чем меньше Ка) , тем сильнее идет гидролиз.
Легко показать, что для гидролиза по катиону Kh= KW/Kb, где Kb - константа диссоциации слабого основания, а для гидролиза и по катиону и по аниону Kh= Kw/Ka×Kb.
Введем степень гидролиза, как отношение прогидролизовавшихся ионов к общему числу ионов:
h=Ch/C, тогда